Chamamos de 1ª Lei da Termodinâmica, o princípio da conservação de energia aplicada à termodinâmica, o que torna possível prever o comportamento de um sistema gasoso ao sofrer uma transformação termodinâmica.
Analisando o princípio da conservação de energia ao contexto da termodinâmica:
Um sistema não pode criar ou consumir energia, mas apenas armazená-la ou transferi-la ao meio onde se encontra, como trabalho, ou ambas as situações simultaneamente, então, ao receber uma quantidade Q de calor, esta poderá realizar um trabalho  e aumentar a energia interna do sistema ΔU, ou seja, expressando matematicamente:
e aumentar a energia interna do sistema ΔU, ou seja, expressando matematicamente:
Sendo todas as unidades medidas em Joule (J).
Conhecendo esta lei, podemos observar seu comportamento para cada uma das grandezas apresentadas:
Calor
|
Trabalho
|
Energia Interna
|
Q/
|
|---|---|---|---|
Recebe
|
Realiza
|
Aumenta
|
>0
|
Cede
|
Recebe
|
Diminui
|
<0
|
não troca
|
não realiza e nem recebe
|
não varia
|
=0
|
Exemplo:
(1) Ao receber uma quantidade de calor Q=50J, um gás realiza um trabalho igual a 12J, sabendo que a Energia interna do sistema antes de receber calor era U=100J, qual será esta energia após o recebimento?
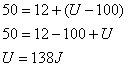









Enviar um comentário